多光子イメージング
過去20年間、生物学におけるイメージングは、フェムト秒の超短パルスレーザー技術の普及により恩恵を受けてきました。フェムト秒(10 -15 s)およびピコ秒(10 -12 s)のパルスは、生物学的サンプル内に独自の物理的プロセスを誘発し、従来の共焦点イメージングでは取得できない貴重な洞察を提供します。従来の共焦点イメージングよりも多光子イメージングが選択される主なモチベーションは、脳組織など不透明なサンプルをより深くイメージングできることにあります。この多光子イメージング実験を成功させるためにはどのような実験条件が必要でしょうか。
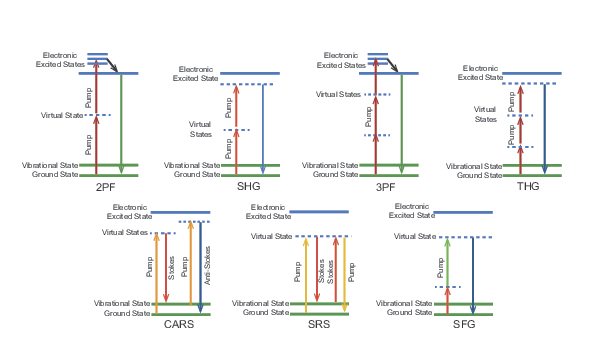
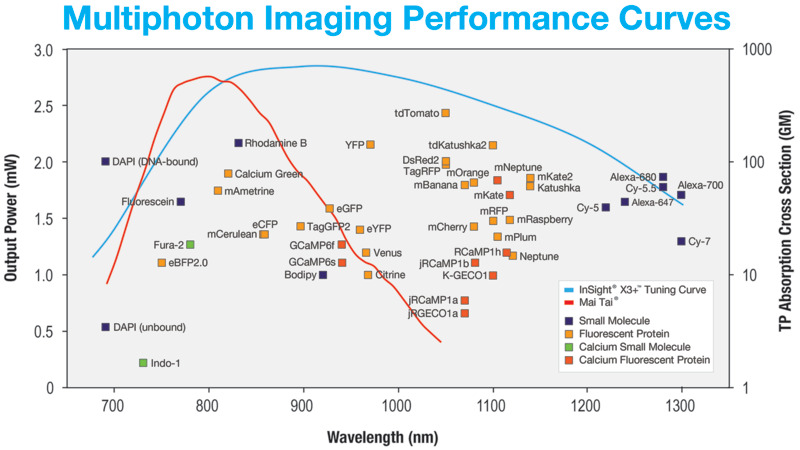
多光子画像は、広範囲の蛍光色素の中から2つ以上の光子の同時吸収によって生成されます。過去10年間で、多光子イメージングに有用な蛍光色素がいくつも出現しそのスペクトル範囲は(680–1300 nm)に拡張しています。これらの色素の概要を図1に示します。色素は、特定の生物学的プロセスと構造を研究するための蛍光マーカーとして使用されます。多光子吸収過程は、光子密度が最も高い領域と相関がある、結果として生じる蛍光は焦点面に局在します。面外蛍光信号を除去するために機械的な開口は必要ありません。これは、散乱と光損傷が少ないことを意味します。また、多光子イメージングは近赤外励起波長を使用しているため、サンプル内に 1 mm 以上の 3 次元画像を生成できます。
多光子イメージングの進化
1990年代初頭以来、チタンサファイアレーザーは多光子イメージングに適した光源となっています。オールソリッドステートの構造は、堅牢で信頼性の高い動作を提供し、近赤外のスペクトル領域全体(700–1000 nm)に渡ります。多光子イメージングの場合、有効な吸収領域は、2光子の場合は(~350–500 nm) 、3光子プロセスの場合は(~233–333 nm)に変換されます。これは、生物学的に関連する蛍光体にとって理想的な範囲です。
最も良く知られている蛍光タンパク質は、900 nmを超える波長で2光子レジームで最適に励起されます。それらは、eGFB(930 nm)、eYFP(960 nm)および1000–1100 nmで最も励起される赤方偏移タンパク質 はmCherry、tdTomato、DSRedおよびE2-クリムゾンなどです。
多光子イメージング用の最新世代のレーザーは、イッテルビウム(Yb)をベースにしています。これらの光源は、非線形周波数変換を利用して、動作波長範囲 680–1300 nmを実現します。これら最新レーザーは波長可変出力に加え、高出力の固定波長出力の第2高調波(SHG)、第3高調波(THG)を提供し、コヒーレント反ストークスラマン散乱(CARS)および誘導ラマン散乱(SRS)などの新しいラベルフリー技術を可能にしました。このようなラベルフリーのモダリティは、生物学的サンプルに自然に存在する内因性構造を明らかにすることができ、一緒に使用すると、従来の多光子イメージングに関連付けられたときに、より詳細な画像が提供されます。下の図1をご参照ください。
マルチモーダルイメージング
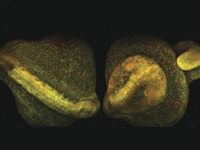
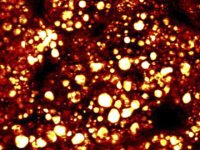
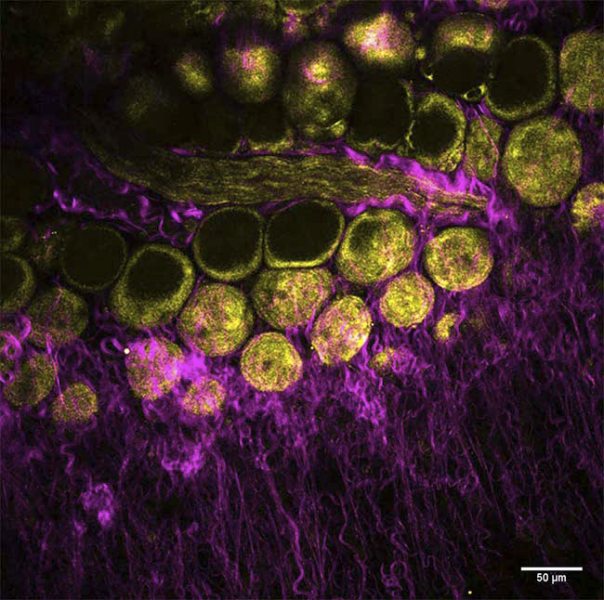
新しいプラットフォームでは、デュアル出力ビームを組み込む事で同時励起を可能にし、絶え間なく変化する、マルチモーダルイメージングのニーズに対応する事が可能となってきていますパリのキュリー研究所/CNRSの Dr.Marie Irondelleは、乳腺の腫瘍発生を研究しています(図2を参照)。この ex vito 実験では、蛍光色素を使用せずにマウス乳腺を画像化しています。Irondelle は、SHGイメージング(マゼンタ)でコラーゲンを、THGイメージング(黄色)で脂肪細胞を同時に観察しました。
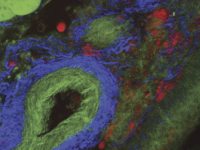
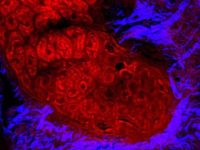
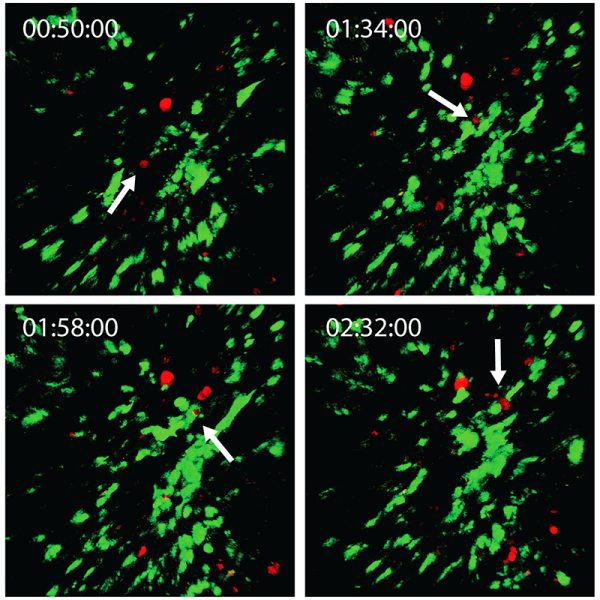
マルチモーダルイメージングモダリティは、in vivo実験の実行に非常に有用となります。シドニーのセンテナリー癌医学細胞生物学研究所の Dr.Michael Kuligowski は、皮膚のT細胞と樹状細胞の間の相互作用を研究しています(図3を参照)。ここでは、CMTPXで標識されたT細胞をドナーマウスから採取し、GFPで標識された樹状細胞を別のマウスに注入しました。GFP標識樹状細胞は 925 nmに調整されたMai Tai DeepSee チタンサファイアレーザーで画像化され、CMTPX標識T細胞は1080 nmに調整されたInSight DS+で画像化されました。実験は、約 40 分間樹状細胞と相互作用する単一のT細胞を観察します。
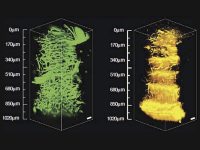
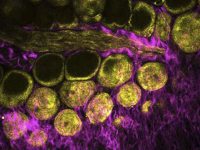
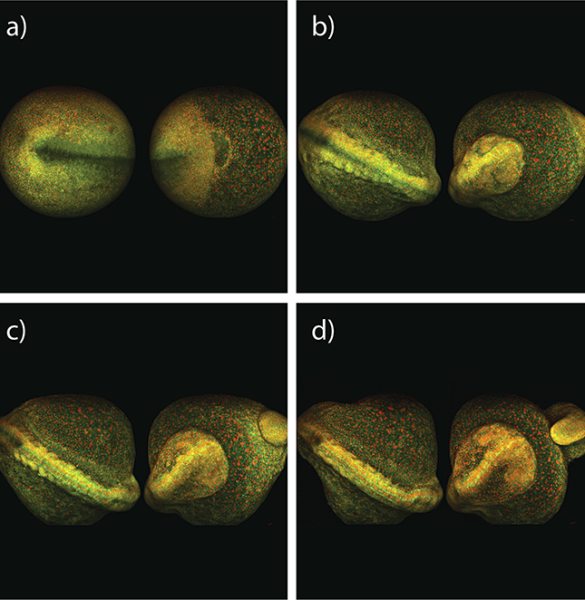
別の実験では、多光子イメージングを使用して、ゼブラフィッシュの胚全体の初期発生を観察します。以下の図4に示すように、フランスのジフシュルイヴェットにあるフランス国立科学研究センターのDr. Nadine Peyrieas は、InSight DS+ Dual を使用して8時間にわたって胚を観察しています。 レーザーのデュアルビーム構成を使用して、980 nm と1041 nmで同時に行われる多光子イメージングが可能となります。胚の細胞膜は eGFP で標識され、細胞核は mCherryで標識されました。
ゼブラフィッシュの全胚の初期発生は、MPEF顕微鏡を使用して出力を抑えたレベルでも継続的に画像化できます。この例では、フランスのジフシュルイヴェットにあるフランス国立科学研究センターのDr.Nadine Peyrieasが、InSight DS+ Dual を組み込んだ顕微鏡を使用して8時間にわたって発生を観察したものです(図4を参照)。胚の細胞膜は eGFP で標識され、細胞核はmCherryで標識化されました。eGFP とmCherry は、レーザーのデュアルビーム構成を使用して、それぞれ 980 nmと1041 nmで同時にイメージングされました。胚は、表側と裏側の両方から順番に画像化されました。
多光子イメージング技術